辉瑞再终止GLP-1药物开发!罗氏、艾伯维等弯道超车?
因安全隐患,辉瑞终止口服GLP-1减肥药Danuglipron研发。
4月14日,辉瑞宣布终止开发口服GLP-1激动剂Danuglipron(PF-06882961),该药物此前正在研究用于慢性体重管理。这是辉瑞在GLP-1减重药上的再次折戟。此前,辉瑞先后叫停了Danuglipron(每日2次)、Lotiglipron两项口服GLP-1制剂的研究。
缺乏有效的药物来治疗肥胖是过去几十年的一大问题,GLP-1的出现一度改变了这个情况。但是,GLP-1虽然可以降低食欲和体重,停药反弹、胃肠道反应、肌肉量下降等争议不断出现。在GLP-1浪潮里,一方面大批企业涌入试图分羹;另一方面,罗氏、艾伯维等新参与者也不只局限于GLP-1类药物的开发,兼顾减重和减少副作用,已成为下一代减肥新药研发的关键方向。
辉瑞又双叒失败了?
时隔不到一年,Danuglipron迎来了最终落幕。
在开发之初,辉瑞将Danuglipron设计为每日2次口服制剂。该制剂在2023年12月顺利完成了减重Ⅱ期研究。数据显示,治疗第26周,Danuglipron所有剂量组患者的体重变化均较安慰剂组明显(-4.8%~-9.4%vs.+0.17%);治疗第32周时,Danuglipron所有剂量组患者的体重变化仍然较安慰剂组明显(-6.9%~-11.7%vs.+1.4%)。经安慰剂调整后,Danuglipron组在第26周和第32周的平均体重下降幅度分别为-5%~-9.5%和-8%~-13%。
Danuglipron(每日2次)的减重效果初现,但其对手Rybelsus(口服司美格鲁肽)已领先多年上市,在此前提下,其并不具备压倒性竞争优势。此外,Danuglipron(每日2次)的胃肠道反应发生率较高(恶心73%,呕吐47%,腹泻25%),停药率(50%)也不低。鉴于以上原因,辉瑞放弃了Danuglipron(每日2次)剂型进入Ⅲ期临床的计划。
然而辉瑞似乎并不甘心就此放弃,2024年7月,辉瑞宣布确定推进其剂型改良版Danuglipron(一日一次),再次重启Danuglipron口服制剂的研究。
但遗憾的是,这次重启未能如愿。辉瑞公告显示,Danuglipron(每日1次,NCT06567327和NCT06568731)的剂量优化研究达到了关键的药代动力学目标,并根据早期对Danuglipron(每日2次)的研究,证实了一种制剂和剂量有可能在Ⅲ期临床测试中提供具有竞争力的疗效和耐受性。
但是,Danuglipron(每日1次)未能克服安全性问题。据悉,根据迄今为止入组的1400多例受试者数据,他们服用Danuglipron(每日1次)后发生肝酶升高的频率与其他GLP-1药物类似。不过,其中一项剂量优化研究中,1例无症状受试者发生了潜在的药物诱导性肝损伤,在停用Danuglipron后病情消退。
在审查了全部信息后,包括迄今为止Danuglipron的所有临床数据以及监管机构的最新意见,辉瑞决定终止开发该分子。自此,Danuglipron大概率无缘在GLP-1减重舞台上再次吸引大众的目光。
辉瑞首席科学官兼研发总裁Chris Boshoff表示,包括肥胖在内的心血管和代谢疾病仍然是未满足医疗需求的重要领域,公司计划继续运用全球能力,推进一系列有可能填补患者护理关键空白的研究性治疗,包括继续开发口服GIPR拮抗剂候选物和其他早期肥胖项目。虽然公司对停止Danuglipron的开发感到失望,但仍然致力于评估和推进有前景的项目,努力为患者带来创新的新药。
事实上,这是辉瑞在GLP-1赛道的第3次折戟。在Danuglipron相关研究终止之前,2023年6月,因正在进行中的I期和Ⅱ期研究发现患者转氨酶升高的副作用,辉瑞选择终止开发口服GLP-1激动剂Lotiglipron(PF-07081532)。目前辉瑞的减重药物管线仅剩一款口服GIPR拮抗剂PF-07976016,处于临床Ⅱ期。
不可否认的是,摆在GLP-1赛道选手眼前的一大难关是肝损伤、胃肠道反应高等安全性问题。除此之外,珠玉在前导致的临床试验难开展、大批企业入围竞争内卷等现状,也给后来者带来不小的挑战。
减重赛道的创新突围
Evaluate Pharma数据显示,预计到2030年,减重药销售额的年增长率将超过40%,达到800亿美元以上。在争夺减重市场这块大蛋糕过程中,继续研究GLP-1或许只能蹭上蛋糕的奶油,与此同时,有的企业已经在深挖蛋糕的“内馅”。
比如,3月24日,联邦制药与诺和诺德达成合作,将UBT251的大中华区外全球权益授权给诺和诺德。据了解,多靶点激动剂可以突破单靶点药物的疗效天花板,UBT251就是针对GLP-1/GIP/GCG受体三靶点激动剂。
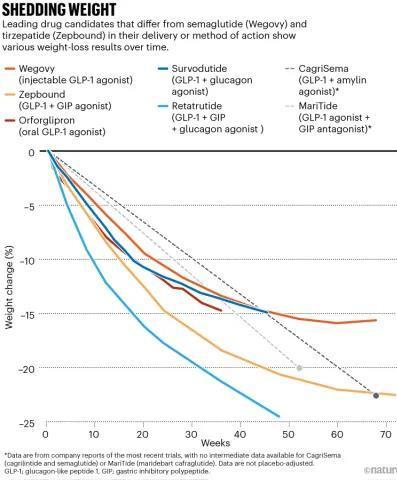
除此之外,联合治疗正成为肥胖治疗的新趋势,其不仅提高了减重效率,还可能通过降低药物剂量减少副作用。例如,诺和诺德CagriSema将长效胰岛淀粉样多肽(胰淀素)类似物与司美格鲁肽结合,在68周的Ⅲ期临床试验中,参与者平均减重近23%。
3月12日,罗氏宣布与Zealand Pharma达成总价高达53亿美元全球合作和许可协议,以开发长效胰淀素类似物petrelintide,作为单药疗法和与CT-388(GLP-1/GIP受体双激动剂)的固定剂量组合产品。
据悉,petrelintide适合每周一次皮下注射,可与其他肽共同配制和共同给药。在Ib期多次递增剂量试验中,petrelintide在16周后平均减重高达8.6%,而合并安慰剂组仅为1.7%。Petrelintide耐受性良好,未发生严重或严重不良事件。
不只是诺和诺德、罗氏,3月初,艾伯维也宣布了与Gubra达成一项合作,共同开发潜在治疗肥胖症的长效胰淀素类似物GUB014295,该项合作的总金额达22亿美元。1月,先为达生物与Verdiva Bio达成一项超24亿美元的合作,合作产品中包括了两款临床前阶段的口服和皮下注射的胰淀素受体激动剂。礼来也没有缺席,去年10月,与瑞士KeyBioscience就双胰淀素(Amylin)和降钙素(Calcitonin)受体激动剂(DACRA)KBP-336达成一项约14亿美元的合作。
在新靶点探索方面,斯坦福医学基于AI算法的多肽预测器(Peptide Predictor),从中识别出新型生物活性多肽,其中有一种仅 12 个氨基酸的多肽BRP,通过独立但相似的代谢途径起作用,并激活大脑中的不同神经元,可以抑制食欲并导致小鼠和猪体重减轻。动物试验还表明其有效,且没有该类型药物的一些副作用,如恶心、便秘和肌肉质量显著下降。
另一方面,基因测序技术的进步也为开发新型减重药物提供了方向。2022年, Alnylam Pharmaceuticals的研究员在一项研究中,确定了一种名为INHBE的基因突变,其与低腰臀比有关,该指标反映了身体中更健康的脂肪分布。
此外,大麻素受体CB1这个存在精神副作用的旧靶点正重新引起关注。有研究人员发现,CB1拮抗剂的减重效果主要通过肝脏、肌肉和胰腺等外周代谢途径实现,而非中枢神经系统。如果能够设计一种无法穿透血脑屏障的CB1拮抗剂,就有望在避免副作用的同时,实现代谢改善。
竞争愈发激烈下,也有企业考虑另辟蹊径。如默沙东实验室总裁Dean Li曾表示,由于竞争激烈,该公司无意涉足GLP-1肽类用于减重、心血管疾病以及睡眠呼吸暂停等常规领域,而将专注于开发此类药物用于他们认为重要的市场。该公司的GLP-1R/GCGR双重激动剂efinopegdutide(MK-6024)将开发用于代谢功能障碍相关脂肪性肝炎(MASH)。
新机制的减重药物可以与已上市药物协同或增强疗效,也存在着解决未满足需求的重要机会。业内人士表示,随着减重市场在未来逐渐成熟,研发策略将从当前的减重效果,转向以体重为主要指标的慢病治疗模式。同时,市场将会继续细分,针对特定群体的不同需求,具有独特优势的产品才能脱颖而出。











还没有评论,来说两句吧...